【通用名称】:
普瑞巴林胶囊
【商品名称】:
乐瑞卡
【英文名称】:
Pregabalin Capsules
【汉语拼音】:
PuRuiBaLinJiaoNang(LeRuiKa)
【性状】:
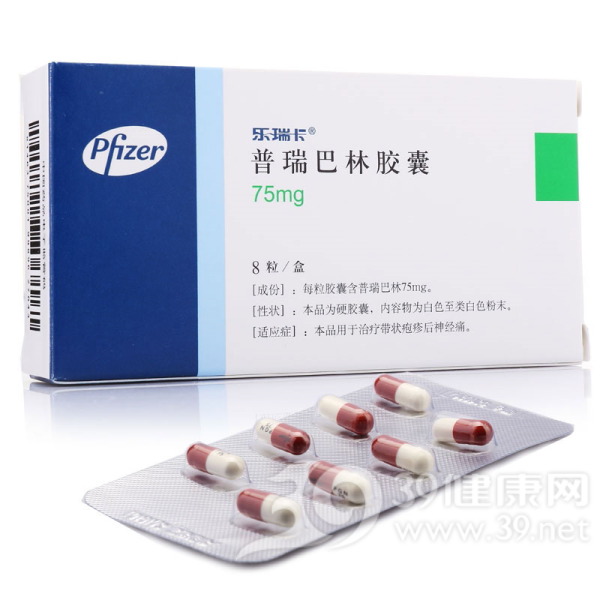
本品为硬胶囊,内容物为白色至类白色粉末。
【用法用量】:
本品可与食物同时服用,也可单独服用。本品推荐剂量为每次75或150mg,每日2次;或者每次50mg或100mg,每日3次。起始剂量可为每次75mg,每日2次;或者每次50mg,每日3次。可在1周内根据疗效及耐受性增加至每次150mg,每日2次。由于本品主要经肾脏排泄清除,肾功能减退的患者应调整剂量。以上推荐剂量适用于肌酐清除率ge;60毫升/分的患者。服用本品300mg/日,2-4周后疼痛未得到充分缓解的患者,如可耐受本品,可增至每次300mg,每日2次,或每次200mg,每日3次(600mg/
【不良反应】:
临床试验的经验:由于临床试验在多种不同情况下进行,不能直接比较一种药物与另一种药物在不同临床试验中的不良反应发生率,该发生率也可能不能代表临床实践中观察到的发生率。普瑞巴林上市前所有对照及非对照试验中,超过10000名来自不同人群的患者服用了本品。大约5000人服药至少6个月,超过3100人服药至少1年,超过1400人服药至少2年。所有上市前对照试验中最常导致停药的不良反应整合上市前对照试验所有人群的数据,因不良反应提前停药的患者比例在普瑞巴林组和安慰剂组分别为14%和7%。普瑞巴林导致停药的最常见不良反应是头晕(4%)和嗜睡(3%)。安慰剂组1%患者因头晕停药,[1%患者因嗜睡停药。对照试验中与安慰剂组比较,普瑞巴林组其它较常见导致停药的不良反应包括共济失调、意识模糊、乏力、思维异常、视物模糊、运动失调及外周水肿(各1%)。所有上市前对照试验中最常见的不良反应整合上市前对照试验所有人群的数据,普瑞巴林组比安慰剂组报告更多(≥5%且不良反应发生率为安慰剂组的两倍)的不良反应为头晕、嗜睡、口干、水肿、视物模糊、体重增加及“思维异常”(主要为集中精力困难/注意困难)。(详见说明书)
【注意事项】:
糖尿病患者当前的临床实践,有些糖尿病患者因接受普瑞巴林治疗而致体重增加时,需要调整降糖药物。血管性水肿:上市后报告中,一些患者在开始使用或长期使用普瑞巴林后出现血管性水肿。特异性症状包括面、口(舌、唇和牙龈)及颈部(咽和喉)肿胀。有血管性水肿导致呼吸系统损伤危及生命,需紧急处理的个例报告。如果患者出现这些症状应立即停用本品。超敏反应:上市后报告中,一些患者开始使用普瑞巴林短时间内出现超敏反应。不良反应包括皮肤发红、水疱、荨麻疹、皮疹、呼吸困难及喘息。如果患者出现这些症状应立即停用本品。停用抗癫痫药物(AEDs):同所有抗癫痫药物一样,普瑞巴林应逐渐减停,从而使癫痫患者发作频率增加的风险最小化。如需停用本品,建议至少用1周时间逐渐减停。外周水肿:普瑞巴林可能引起外周水肿。短期临床试验(患者无具有显著临床意义的心脏疾病或外周血管疾病)未显示外周水肿与心血管并发症(如高血压或充血性心力衰竭)有明确的关联。外周水肿与提示肝肾功能减退的实验室检查变化无关。(详见说明书)请仔细阅读说明书并遵医嘱使用。
【儿童注意事项】:
由于该人群中安全性和疗效的数据不充足,年龄小于12岁的儿童和青少年(12-17岁)不推荐使用本品。
【妊娠与哺乳期注意事项】:
动物研究显示本品具有生殖毒性。(见【药理毒理】)。本品对人类的可能风险目前未知。尚无本品对女性生育力影响的临床数据。在一项评价本品对精子活动力影响的临床试验中,健康男性受试者暴露于600mg/天剂量的本品。给药3个月后,未发现精子活动力受到影响。妊娠妇女使用普瑞巴林的数据不足,除非必要(孕妇服药的益处明显大于药物对胎儿的潜在风险),否则妊娠期间不应服用本品。育龄妇女必须应用有效的避孕措施。目前尚不清楚普瑞巴林是否经母乳分泌;但是,本品可经大鼠的乳汁分泌。因此,不建议在应用普瑞巴林治疗期间哺乳。
【老人注意事项】:
老年患者(年龄65岁以上)由于肾功能减退可能需要减量(见【用法用量】肾功能损伤患者用药)。
【药物相互作用】:
由于普瑞巴林主要以原型药物的形式经尿液排泄,可忽略本品在人体内的代谢(尿液中仅发现不到给药剂量2%的药物代谢产物)。离体研究显示,普瑞巴林不抑制药物代谢,也不与血浆蛋白结合,普瑞巴林几乎不与其它药物发生药代动力学的相互作用。同样,在动物研究中没有观察到普瑞巴林与苯妥英、卡马西平、丙戊酸、拉莫三嗪、加巴喷丁、劳拉西泮、羟考酮或乙醇之间发生临床相关药代动力学的相互作用。人群药代动力学分析显示口服抗糖尿病药、利尿药、胰岛素、苯巴比妥、噻加宾及托吡酯对普瑞巴林的清除无显著临床影响。普瑞巴林与口服避孕药炔诺酮和/或
【药理作用】:
药理作用普瑞巴林与中枢神经系统中α2-δ位点(电压门控钙通道的一个辅助性亚基)有高度亲和力。普瑞巴林的作用机制尚不明确,但是转基因小鼠和结构相关化合物(例如加巴喷丁)的研究结果提示,在动物模型中的镇痛及抗惊厥作用可能与普瑞巴林与α2-δ亚基的结合有关。体外研究显示,普瑞巴林可能通过调节钙通道功能而减少一些神经递质的钙依赖性释放。虽然普瑞巴林是抑制性神经递质g-氨基丁酸(GABA)的结构衍生物,但它并不直接与GABAA,GABAB或苯二氮卓类受体结合,不增加体外培养神经元的GABAA反应,不改变大鼠脑中GABA浓度,对GABA摄取或降解无急性作用。但是研究发现,体外培养的神经元长时间暴露于普瑞巴林,GABA转运蛋白密度和功能性GABA转运速率增加。普瑞巴林不阻滞钠通道,对阿片类受体无活性,不改变环加氧酶活性,对多巴胺及5-羟色胺受体无活性,不抑制多巴胺、5-羟色胺或去甲肾上腺素的再摄取。毒理研究遗传毒性:体外研究显示普瑞巴林对细菌及哺乳动物细胞无致突变作用,体内及体外研究均显示普瑞巴林不会导致哺乳动物染色体畸变,在大鼠或小鼠中不诱导肝细胞程序外DNA合成。生殖毒性:雄性大鼠交配前至交配过程中经口给予普瑞巴林(50至2500mg/kg),与未给药雌性大鼠交配,可见对生殖及发育的多种不良影响,包括精子计数减少,精子活动力下降,精子异常增加,生育力下降,着床前丢失率增加,窝仔数减少,胎仔体重降低及胎仔异常发生率增加。在研究期内(3-4个月),对精子及生育力参数的影响是可逆的。对雄性大鼠生殖的无影响剂量(100mg/kg)时,血浆普瑞巴林的暴露量(AUC)约相当于临床最大推荐剂量(MRD)时人暴露量的3倍。此外,在4周或更长时间的一般毒性研究中,雄性大鼠在剂量为500-1250mg/kg时,组织病理学检查可见生殖器官(睾丸,附睾)不良反应,无影响剂量为250mg/kg,约相当于MRD时人血浆暴露量的8倍。雌性大鼠交配前、交配过程中及妊娠早期经口给予普瑞巴林500、1250、2500mg/kg,各剂量下均可见发情周期紊乱及交配天数增加,高剂量下可见胚胎死亡。低剂量下普瑞巴林的血浆暴露量约相当于人MRD时暴露量的9倍,未确定无影响剂量。妊娠期大鼠和家兔在普瑞巴林血浆暴露量(AUC)相当于≥5倍MRD时的暴露量时,可见胎仔结构畸形和其它发育毒性的发生率增加,包括胎仔死亡、生长迟缓、神经及生殖系统功能损害。妊娠大鼠于器官形成期经口给予普瑞巴林500、1250或2500mg/kg,低剂量时血浆普瑞巴林暴露量(AUC)约相当于MRD时人暴露量的17倍。剂量≥1250mg/kg时,异常提前骨化(颧骨及鼻骨间缝过早融合)导致的特异性颅骨异常发生率增加。各剂量下均可见骨骼变异及骨化延迟。高剂量下胎仔的体重降低。尚未确立普瑞巴林对大鼠胚胎-胎仔发育的无影响剂量。妊娠期家兔于器官形成期经口给予普瑞巴林250、500或1250mg/kg。高剂量下可见胎仔体重降低、骨化延迟、骨骼畸形及内脏变异发生率增加。对家兔发育的无影响剂量为500mg/kg,血浆暴露量约相当于MRD时人暴露量的16倍。在围产期毒性试验中,大鼠经口给予普瑞巴林50、100、250、1250或2500mg/kg,≥100mg/kg时子代生长减缓,≥250mg/kg时子代存活率降低。≥1250mg/kg时对子代存活率产生显著影响,最高剂量时窝仔死亡率为100%。子代成年后测试,≥250mg/kg时可见神经行为异常(听觉惊恐反应降低),1250mg/kg时可见生殖功能损害(生育力降低,窝仔数减少)。对大鼠围产期发育的无影响剂量为50mg/kg,血浆暴露量约相当于MRD时人暴露量的2倍。致癌性:B6C3F1与CD-1小鼠掺食法给予普瑞巴林200、1000、5000mg/kg,连续2年,可见血管源性恶性肿瘤(血管肉瘤)发生率剂量依赖性增加。最低剂量下小鼠血浆普瑞巴林暴露量(AUC)约相当于MRD时的暴露量,尚未确定小鼠血管肉瘤诱导的无影响剂量。Wistar大鼠掺食法给予普瑞巴林,连续2年,雄性大鼠剂量为50、150、450mg/kg,雌性大鼠剂量为100、300、900mg/kg,最高剂量分别相当于MRD时人暴露量的14倍和24倍,未见肿瘤发生率增加。其他毒性皮肤毒性在大鼠及猴重复给药毒性试验中可见皮肤损伤,病变程度从红斑到坏死,其病因尚不明确。普瑞巴林导致皮损的剂量是MRD的两倍。在血浆普瑞巴林暴露量(AUC)为MRD时人暴露量的3–8倍时出现更为严重的皮肤病变,包括坏死。临床试验中未见皮肤病变发生率增加。眼部病变在两项Wistar大鼠致癌性试验中可见眼部病变(特征性表现为视网膜萎缩[包括光感受器细胞缺失]和/或角膜炎症/矿物沉积),出现改变时的血浆普瑞巴林暴露量(AUC)是MRD时人暴露量的≥2倍,未确立无影响剂量。在两种品系小鼠2年致癌性试验或猴给药1年致癌性研究中未见类似病变。(详见说明书)

 陈士俊主任医师
陈士俊主任医师
 龚树生主任医师
龚树生主任医师
 王玉霞
王玉霞
 曹曼林主任医师
曹曼林主任医师
 王凤玲主任医师
王凤玲主任医师











 3
3
 北京协和医院
北京协和医院
 贵州省第二人民医院
贵州省第二人民医院
 北京大学第三医院
北京大学第三医院
 上海交通大学医学院附属瑞金医院
上海交通大学医学院附属瑞金医院
 首都医科大学附属北京儿童医院
首都医科大学附属北京儿童医院